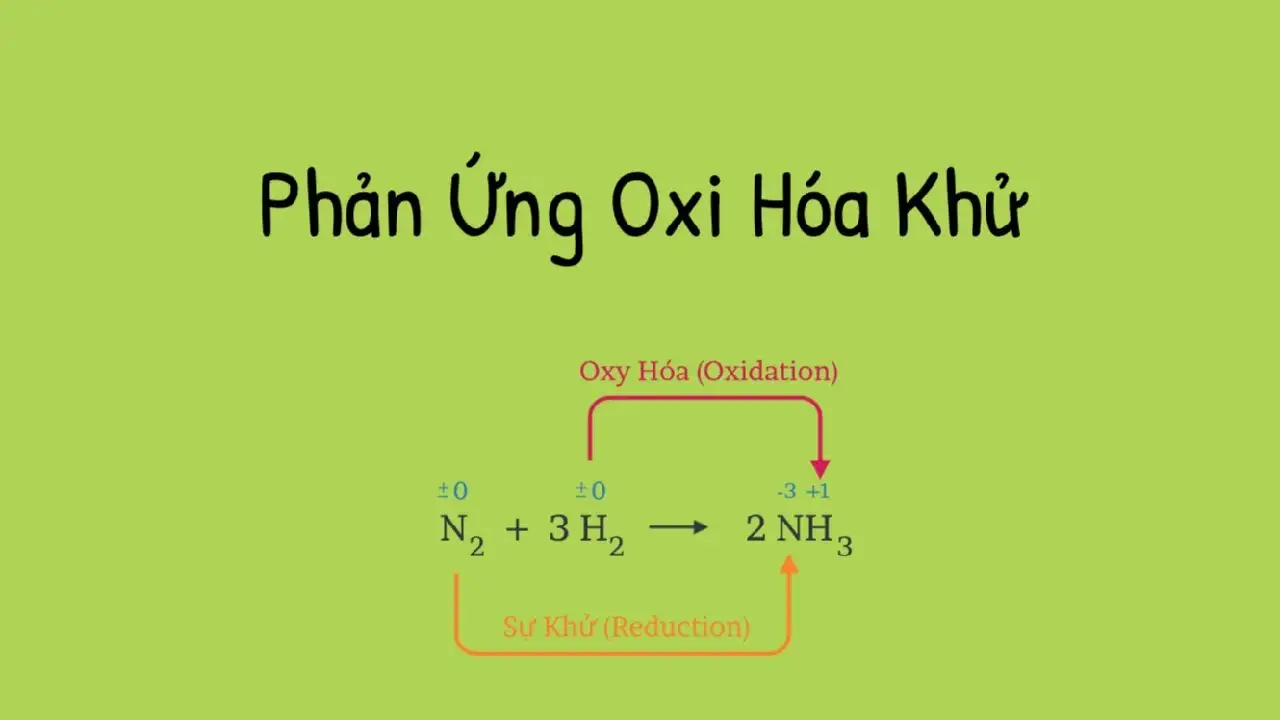
Phản ứng oxi hóa khử là một trong những khái niệm quan trọng trong hóa học, đóng vai trò cốt lõi trong nhiều quá trình tự nhiên và công nghiệp. Bài viết này sẽ giúp bạn hiểu rõ phản ứng oxi hóa khử là gì, cách nhận biết, cân bằng phương trình và ứng dụng thực tiễn của nó, được trình bày chuẩn SEO để dễ dàng tiếp cận.
Phản ứng oxi hóa khử là gì?
Phản ứng oxi hóa khử (hay còn gọi là phản ứng redox) là quá trình hóa học trong đó xảy ra sự chuyển giao electron giữa các chất. Cụ thể:
- Oxi hóa: Là quá trình một chất mất electron, dẫn đến số oxi hóa tăng.
- Khử: Là quá trình một chất nhận electron, làm giảm số oxi hóa.
Ví dụ: Trong phản ứng cháy của metan (CH₄) với oxi (O₂):
CH₄ + 2O₂ → CO₂ + 2H₂O
Metan bị oxi hóa thành CO₂, còn O₂ bị khử thành H₂O.
Đặc điểm của phản ứng oxi hóa khử
- Có sự thay đổi số oxi hóa của ít nhất hai nguyên tố.
- Luôn có chất oxi hóa (nhận electron) và chất khử (cho electron).
- Phản ứng thường giải phóng hoặc hấp thụ năng lượng dưới dạng nhiệt hoặc ánh sáng.
Cách nhận biết phản ứng oxi hóa khử
Để nhận biết một phản ứng hóa học có phải là phản ứng oxi hóa khử hay không, bạn cần:
- Xác định số oxi hóa: So sánh số oxi hóa của các nguyên tố trước và sau phản ứng. Nếu có sự thay đổi, đó là phản ứng redox.
- Kiểm tra sự chuyển giao electron: Xem xét xem có chất nào mất hoặc nhận electron.
- Nhận diện chất oxi hóa và chất khử:
- Chất oxi hóa: Chất nhận electron, thường chứa nguyên tố có độ âm điện cao (như O₂, Cl₂).
- Chất khử: Chất mất electron, thường là kim loại hoặc hợp chất giàu electron (như H₂, Zn).
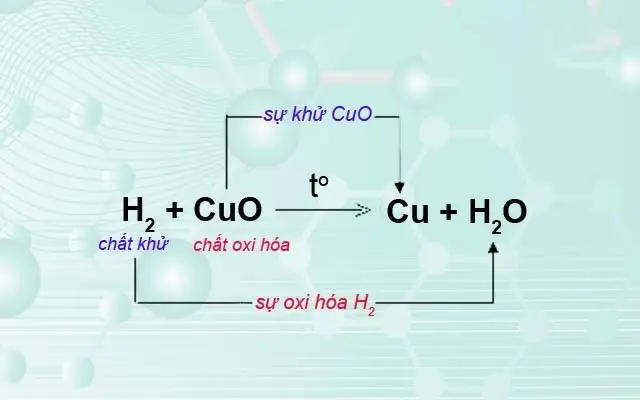
Ví dụ: Trong phản ứng:
2H₂ + O₂ → 2H₂O
H₂ là chất khử (mất electron), O₂ là chất oxi hóa (nhận electron).
Cách cân bằng phương trình phản ứng oxi hóa khử
Cân bằng phương trình phản ứng oxi hóa khử đòi hỏi sự chính xác để đảm bảo tuân thủ định luật bảo toàn khối lượng và bảo toàn điện tích. Có hai phương pháp phổ biến:
Phương pháp thăng bằng electron
- Xác định số oxi hóa của các nguyên tố.
- Viết nửa phản ứng oxi hóa và nửa phản ứng khử.
- Cân bằng số electron chuyển giao giữa hai nửa phản ứng.
- Kết hợp hai nửa phản ứng và cân bằng các nguyên tố còn lại (H, O…).
Ví dụ: Cân bằng phản ứng:
Fe + CuSO₄ → FeSO₄ + Cu
- Nửa phản ứng oxi hóa: Fe → Fe²⁺ + 2e⁻
- Nửa phản ứng khử: Cu²⁺ + 2e⁻ → Cu
- Phương trình tổng: Fe + Cu²⁺ → Fe²⁺ + Cu
Phương pháp thăng bằng trong môi trường axit/kiềm
Trong môi trường axit hoặc kiềm, cần thêm H⁺, OH⁻ hoặc H₂O để cân bằng. Ví dụ, trong môi trường axit:
MnO₄⁻ + Fe²⁺ → Mn²⁺ + Fe³⁺
- Cân bằng O bằng H₂O, cân bằng H bằng H⁺, sau đó cân bằng điện tích bằng electron.
Ứng dụng thực tiễn của phản ứng oxi hóa khử
Phản ứng oxi hóa khử có vai trò quan trọng trong nhiều lĩnh vực:
- Công nghiệp:
- Sản xuất kim loại từ quặng (như luyện thép từ quặng sắt).
- Sản xuất pin và ắc quy (pin lithium-ion, pin kẽm-carbon).
- Môi trường:
- Xử lý nước thải bằng cách sử dụng chất oxi hóa để phân hủy chất ô nhiễm.
- Quá trình quang hợp trong tự nhiên, chuyển CO₂ và H₂O thành glucose và O₂.
- Y học:
- Sử dụng chất oxi hóa như H₂O₂ để khử trùng.
- Quá trình hô hấp tế bào, nơi glucose bị oxi hóa để tạo năng lượng.
- Năng lượng:
- Phản ứng trong pin nhiên liệu, cung cấp năng lượng cho xe điện hoặc thiết bị.
Một số lưu ý khi học phản ứng oxi hóa khử
- Hiểu rõ số oxi hóa: Đây là nền tảng để nhận diện và cân bằng phản ứng.
- Thực hành cân bằng phương trình: Luyện tập với nhiều ví dụ để nắm vững các phương pháp.
- Ứng dụng thực tế: Liên hệ với các hiện tượng trong đời sống để hiểu sâu hơn.
Kết luận
Phản ứng oxi hóa khử là một chủ đề quan trọng trong hóa học, không chỉ xuất hiện trong sách giáo khoa mà còn có ứng dụng rộng rãi trong công nghiệp, môi trường và y học. Việc nắm vững khái niệm, cách nhận biết và cân bằng phương trình sẽ giúp bạn hiểu rõ hơn về các quá trình hóa học xung quanh.
Nếu bạn muốn tìm hiểu thêm về các ví dụ cụ thể hoặc cách giải bài tập về phản ứng oxi hóa khử, hãy để lại câu hỏi hoặc theo dõi các bài viết tiếp theo của chúng tôi!